近10年来,国自然中「巨噬细胞」中标量呈现一个直线增长的趋势,在2023年达到了888个中标数目,因此,巨噬细胞一直都是国自然申请中大家重点关注的内容。
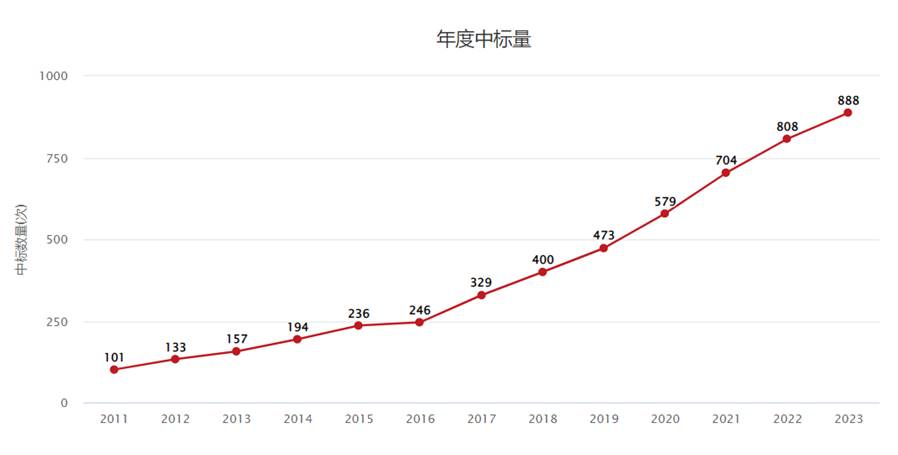
(来源:ZCOOL国家自然科学基金查询)
今天小编要为大家分享的是一篇关于「巨噬细胞」的综述。
这篇综述题为Metabolism, metabolites, and macrophages in cancer,于2023年7月发表在《Journal of Hematology & Oncology》(IF:28.5)上。
引言
引言
巨噬细胞是先天性和适应性免疫系统的重要组成部分,与其他吞噬细胞一起,它们通过释放促炎细胞因子形成最初的防线,这有助于激活先天免疫系统以及随后的T和B细胞反应。
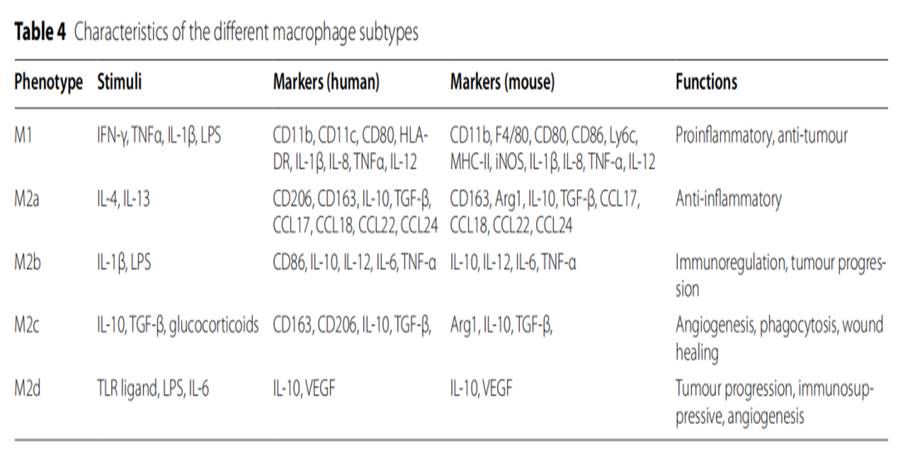
巨噬细胞在不同的刺激或微环境下可进一步极化为不同的表型。在典型的分类中,促炎性巨噬细胞通过脂多糖(LPS)诱导获得M1表型,抗炎性巨噬细胞通过IL-4或IL-13诱导获得M2表型。
除了IL-4/IL-13诱导的M2a表型外,M2巨噬细胞亚群还可以根据其具体功能进一步细分为不同的亚型。
❶ 其中一种亚型由M2b巨噬细胞组成,也称为调节性巨噬细胞。它们被免疫复合物和TLR配体激活,参与免疫和炎症反应,产生促炎和抗炎细胞因子。
❷ 另一种亚型由M2c巨噬细胞组成,它们被糖皮质激素或IL-10激活,主要发挥抗炎功能。
❸ M2d巨噬细胞,可被TLR配体和A2腺苷受体激动剂激活,在调节肿瘤进展、血管生成和转移中发挥着至关重要的作用。
肿瘤微环境(TME)内的巨噬细胞称为肿瘤相关巨噬细胞(TAMs)。TAMs作为浸润TME的重要免疫细胞,具有表型可塑性和异质性的特点。
在肿瘤形成的起始阶段,TAMs主要发挥促炎作用,抑制肿瘤的发展。随着肿瘤的生长,TME中的巨噬细胞通过Th2细胞的作用获得M2样表型,这些细胞毒性巨噬细胞然后转化为肿瘤支持巨噬细胞,促进肿瘤进展。此外,TAMs的特定亚群与肿瘤发生、血管生成、血管化、免疫抑制、转移、治疗抵抗和较差的临床结局等多种过程相关。
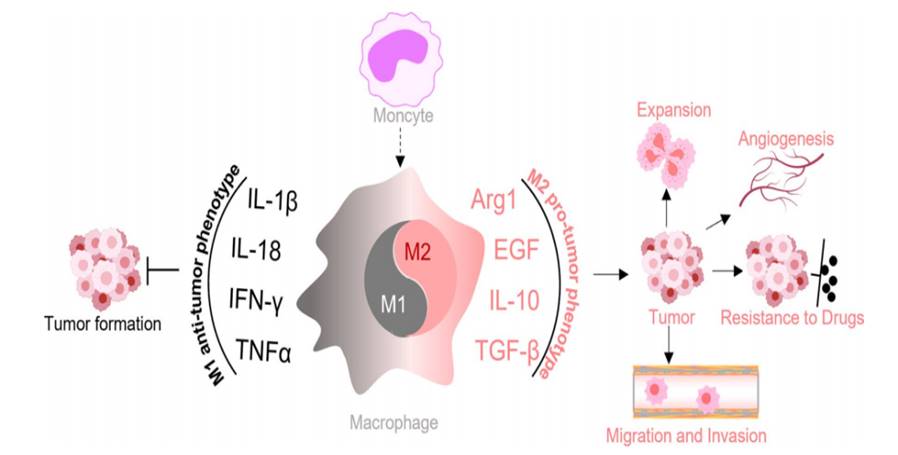
代谢研究表明,肿瘤微环境中TAMs和代谢物的代谢特征调节TAMs的功能和极化。一般来说,M1巨噬细胞主要依赖于有氧糖酵解,而M2巨噬细胞则依赖于氧化代谢。
TME内细胞的代谢变化不仅对肿瘤进展而且对免疫细胞的功能产生深远影响。了解代谢对免疫细胞功能的影响对于开发新型免疫治疗策略至关重要。
在这篇综述中,作者讨论了代谢途径对巨噬细胞功能和极化的影响,以及在癌症治疗中重新编程巨噬细胞代谢的潜在策略。
巨噬细胞代谢和极化之间的串扰
巨噬细胞作为先天免疫系统的重要组成部分,表现出高度的可塑性。M1型巨噬细胞具有糖酵解增强、谷胱甘肽水平升高、铁蛋白表达增加、环氧合酶(COX)2表达升高、COX1表达降低、诱导型一氧化氮合酶(iNOS)2活性增强和精氨酸酶1活性降低。然而,M2型巨噬细胞表现为脂肪酸氧化(FAO)增强、铁蛋白表达低、谷胱甘肽水平降低、COX2产生减少、COX1产生增加、iNOS活性减弱和Arg1活性增加。

■ 葡萄糖代谢
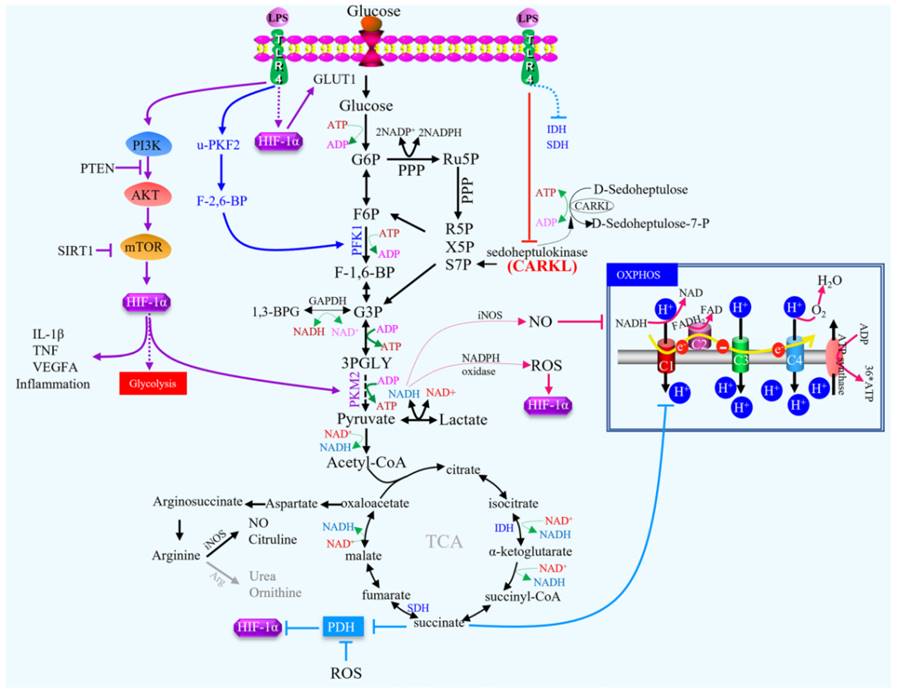
通过LPS/IFN-γ、单核细胞增多性李斯特菌、硫代乙醇酸盐、TLR-2、-3、-4或-9激活M1巨噬细胞,无论激活的途径如何,都会导致相似的无氧糖酵解通量分布模式。
然而,通过替代途径的刺激具有较小的代谢影响。
在动物模型中观察到,这两种行为之间差异的分子基础涉及PFK2的表达从肝型PFK2转换为更活性的普遍存在的PFK2同工酶,其对HIF-1α激活作出反应,并增加果糖-2,6-二磷酸的浓度和糖酵解通量。
当巨噬细胞被白细胞介素(IL)-4和IL-13激活时,情况正好相反,它们促进了另一种表型,通常被称为M2巨噬细胞,与组织修复和体液免疫、抗炎细胞因子产生、MHC-II表达减少和抗原提呈有关。它们表现出增强的OXPHOS和更低的糖酵解率,并且表达PFKFB1,而不是PFKFB3。
此外,在磷酸戊糖途径(PPP)中,碳水化合物激酶样(CARKL)蛋白,也称为景天庚酮糖激酶(SHPK),在调节巨噬细胞代谢中起着关键作用,可以影响巨噬细胞极化,从而催化巨噬细胞产生7-磷酸景天庚糖(S7P)作为平衡非氧化PPP和糖酵解代谢中间体的限速步骤。
在体外和体内,SHPK在LPS刺激下都会下调,并且SHPK的下调对于M1样代谢重编程至关重要。此外,SHPK通过抑制NF-κB来拮抗LPS诱导的细胞因子产生(即TNF-α和IL-6)。
M1巨噬细胞驱动多个需要大量NADPH的过程,特别是NADPH氧化酶依赖性呼吸爆发和谷胱甘肽生物合成,以缓冲活性氧(ROS)。ROS可以进一步激活NF-kB信号传导,促进PD-L1转录并从TAM中释放免疫抑制趋化因子。
■ 脂质代谢
脂质组学研究证实脂质代谢与巨噬细胞活化有关。然而,当过量的胆固醇被吸收时,巨噬细胞中的胆固醇代谢异常会导致多种病理变化。
巨噬细胞中丰富的内质网和游离胆固醇促进胆固醇酰基转移酶1(ACAT1)的酯化,进而导致更多游离胆固醇的产生,并增加脂筏诱导的炎症信号,尤其是TLRs和NF-κB。
TLR激动剂促进二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)生物合成非典型花生四烯酸,并在M2巨噬细胞的组织修复过程中产生抗炎脂质调节因子。
值得注意的是,内源性氧化脂质可以同时促进LPS刺激的吞噬细胞中的OXPHOS和有氧糖酵解。
研究还表明,IL-4刺激的M2巨噬细胞的脂肪酸吸收和氧化显着增加,而M1巨噬细胞的脂肪酸吸收和氧化受到抑制。
人类M1和M2巨噬细胞之间花生四烯酸途径相关酶的表达存在显著差异,它们表达高水平的环氧合酶2(COX2)和低水平的COX1、白三烯A4水解酶(LTA4H)。用IFN-γ和/或LPS刺激后,ALOX15和花生四烯酸5-脂氧合酶(ALOX5)显著增加,而用IL-4处理巨噬细胞后,ALOX15和COX1显著增加。
过氧化物酶体增殖物激活受体(PPAR)是一种配体依赖性转录因子,作为脂肪酸受体调节糖脂代谢,可进一步分为三个亚组:PPARα、PPARδ和PPARγ。
PPARα和PPARγ广泛表达于人和小鼠单核细胞和巨噬细胞中,并抑制巨噬细胞中促炎基因的表达。因此,一般认为PPAR具有防止M1极化的作用,近年来其对M2极化的作用也逐渐被发现。
PPARγ控制编码分子的基因表达,这些分子介导脂质代谢的各个方面,包括储存、脂肪分解和胆固醇输出。
PPARγ影响M2极化,主要在转录水平促进脂肪酸ω氧化和线粒体生成,并且可以与PGC-1β偶联,直接调节Arg1的产生。同样,体内和体外巨噬细胞中PPARγ的敲除抑制了M2巨噬细胞的活化,并降低了Arg1的产生。
PGC-1β是PPAR的转录共刺激因子,可增加脂肪酸氧化相关基因的表达并促进OXPHOS。IL-4极化M2过程中,脂肪酸代谢显着改善,脂肪酸的氧化吸收和线粒体数量也明显改善,主要是因为IL-4激活转录因子STAT6,进一步诱导PGC-1β的产生。
PGC-1β的细胞内过度表达促进M2极化并减轻巨噬细胞相关的炎症反应。相反,条件性敲除PGC-1β抑制细胞内OXPHOS和M2功能,显着促进LPS激活的M1炎症反应。
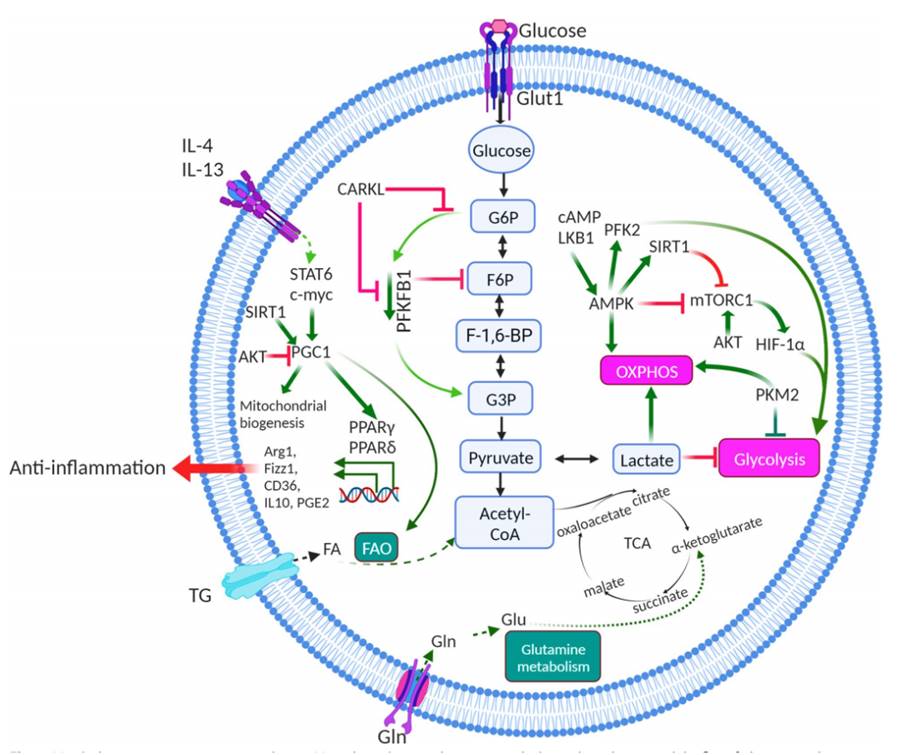
巨噬细胞中的代谢重编程。M1-极化巨噬细胞主要依赖于葡萄糖和葡萄糖转化为乳酸的通量、活性氧(ROS)的产生和一氧化氮(NO)的产生,用于在细胞因子IFN-γ、TNF和LPS刺激后杀死肿瘤,这涉及细胞内在向有氧糖酵解、ROS的产生、TCA循环的破坏和OXPHOS的抑制。M2极化巨噬细胞主要依赖于脂肪酸的β氧化和细胞因子IL-4、IL-13和IL-10刺激后的三羧酸循环(TCA循环)。在这些过程中,一些关键分子参与代谢机制,包括mTOR,HIF-1α,SIRT1和AKT
■ 氨基酸代谢
氨基酸分解代谢升高在多种癌症中很常见。
SLC7A5是一种重要的转运蛋白,已被证明介导肿瘤和T细胞中氨基酸的摄取,并且已证实SLC7A5介导的代谢重编程在巨噬细胞极化中起主要作用。SLC7A5通过mTORC1信号通路诱导亮氨酸流入并上调糖酵解重编程,从而促进巨噬细胞释放促炎细胞因子。
鸟氨酸脱羧酶(ODC)是多胺生物合成中的限速酶,限制胃肠道(GI)感染中M1巨噬细胞的活化,通过损害刺激上皮修复的M1反应,从而增强上皮损伤相关结肠炎和结肠炎相关癌变(CAC),抗微生物防御和抗肿瘤免疫。
精氨酸酶2(ARG2)通过调节精氨酸代谢来驱动神经母细胞瘤细胞增殖,精氨酸代谢将浸润单核细胞极化为M1巨噬细胞表型,以RAC-α丝氨酸/苏氨酸蛋白激酶(AKT)依赖性方式释放IL-1β和TNF-α。
调节巨噬细胞极化的代谢物
巨噬细胞代谢的变化伴随着中间代谢的改变。具体而言,TCA循环期间产生的代谢物在巨噬细胞的调节中发挥重要作用。
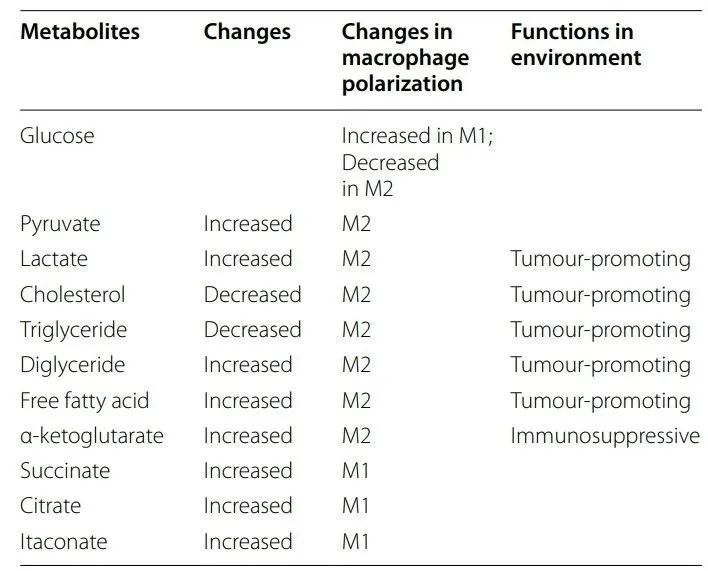
1、珀酸琥珀酸盐是TCA循环的中间产物,在LPS刺激下显著增加。LPS增加的琥珀酸水平在稳定HIF-1α和通过削弱脯氨酰羟化酶(PHD)活性促进促炎巨噬细胞产生IL-1β方面发挥着至关重要的作用。体外和体内研究表明,TME中肿瘤来源的琥珀酸可以激琥珀酸酯激活琥珀酸酯受体1(SUCNR1),导致巨噬细胞极化为TAMs。
2、酸LPS处理的巨噬细胞表现出免疫反应基因1(IRG1)的高表达,该基因催化顺乌头酸脱羧产生衣康酸。然而,Lampropoulou等证明衣康酸通过抑制琥珀酸脱氢酶(SDH)的产生来发挥抗炎作用,导致琥珀酸积累增加并降低线粒体活性氧(ROS)水平,从而抑制促炎细胞因子的释放。此外,衣康酸抑制M2巨噬细胞极化,因为它抑制JAK1和STAT6激活。
3、酮戊二酸研究人员发现谷氨酰胺产生的α-酮戊二酸(α-KG)通过Jmjd3信号通路促进M2极化。此外,α-KG通过以PHD依赖性方式抑制NF-κB通路来抑制M1巨噬细胞功能。
4、酸盐柠檬酸盐已被证明可以通过不同的机制诱导促炎或抗炎巨噬细胞极化。先前的研究表明,源自线粒体的柠檬酸盐促进促炎巨噬细胞的激活。线粒体柠檬酸载体(CIC)促进LPS激活的巨噬细胞中线粒体柠檬酸的输出,从而导致HIF-1α表达增加。HIF-1α反过来又上调IRG1,导致衣康酸的产生。抑制CIC可抑制柠檬酸盐积累,并通过阻断衣康酸分流增强线粒体氧化,最终导致LPS刺激后BMDM极化从M1转变为M2。
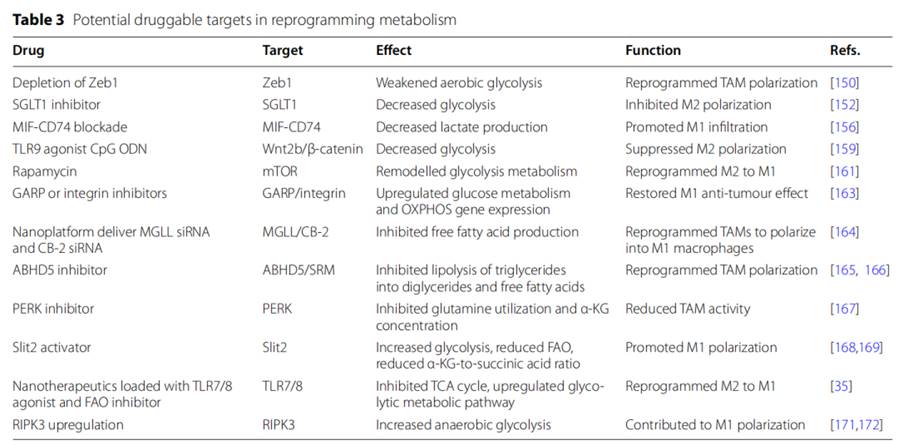
通过重编程代谢来靶向TAMs的可行策略
作为TME中免疫细胞的主要组成部分,TAM在肿瘤进展中发挥着关键作用。针对TAM的策略主要集中在TAM缺失、抑制TAM募集和TAM极化重编程。然而,这些方法的治疗效果仍然不理想,肿瘤治疗中迫切需要针对TAM的新的有效疗法。
最近的研究强调了代谢重编程在控制巨噬细胞功能和极化中的作用,从而引发了旨在调节巨噬细胞的各种临床实验。
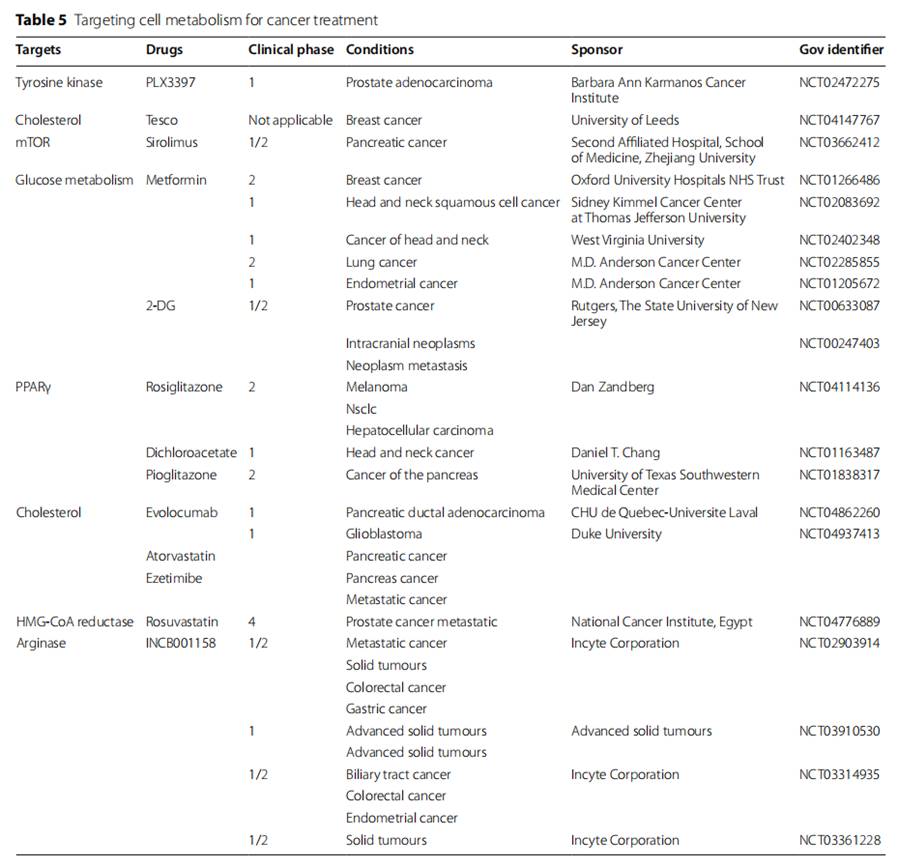
在这部分,作者总结了通过重编程代谢来靶向TAMs的可行策略。
(1)通过有氧糖酵解调节TAM功能
(2)通过脂质代谢调节TAM功能
(3)通过三羧酸循环代谢调节TAM功能
(4)通过氨基酸代谢调节TAM功能
(5)通过磷脂酰肌醇代谢调节TAM功能
总结
最近,肿瘤免疫治疗取得了巨大进展。例如,免疫检查点阻断疗法已成功杀死了多种类型的实体瘤,CAR-T疗法在血液系统恶性肿瘤的治疗中也显示出良好的效果。然而,由于严重的毒性,CAR-T细胞疗法的广泛应用受到限制。因此,靶向TAM是肿瘤免疫治疗的必要且有前景的策略。
TAM 浸润与许多恶性肿瘤的不良预后相关,但关于 TAM 代谢变化对肿瘤进展的影响知之甚少。
代谢重编程导致 TAM 的功能改变和复极化。糖酵解增加、FAO 减少和重新编程的 TCA 循环促进 TAM 复极化以获得促炎表型。代谢重编程过程中产生的代谢物(例如乳酸、α-KG 和琥珀酸)也调节巨噬细胞的活化。因此,了解代谢改变和巨噬细胞功能所涉及的因素之间的相互作用至关重要。
近年来,放疗和化疗在恶性肿瘤的治疗中显示出良好的疗效。然而,放疗和化疗耐药性仍然是有效癌症治疗的巨大挑战。
许多研究表明,脂质代谢异常与放疗和化疗耐药有关。此外,CPT1A 已被证明在放射抗性癌细胞中高表达,并且可以增加脂肪酸氧化(FAO)效率,而抑制脂肪酸合成或靶向CPT1A会减弱放射抗性并减少放射介导的ERK激活。
辐射以剂量依赖性方式促进巨噬细胞分化成不同的表型。例如,高剂量照射(20 Gy)触发巨噬细胞极化以获得抗炎表型,而低剂量照射(2 Gy)则使巨噬细胞偏向抗肿瘤表型。因此,探索 TAM 在接受不同辐射剂量处理后的代谢重编程可能很重要。













